O átomo é a menor partícula capaz de identificar um elemento químico e participar de uma reação química.
O estudo do átomo se iniciou na Grécia antiga com o filósofo Leucipo e seu discípulo Demócrito: para eles, o átomo era o menor componente de toda a matéria existente. Sendo, então, impossível dividí-lo em partes menores.
Ao desenrolar da história, diversos cientistas e estudiosos tentaram definir o átomo quanto a sua forma, dando origem a diversas teorias sobre sua constituição física. Surgiram, então, os modelos atômicos.
Modelos Atômicos
Modelo de Dalton (bola de bilhar) – 1803
Para John Dalton, a teoria de Leucipo e Demócrito era bastante coerente. Segundo este modelo, os átomos eram as menores partículas possíveis, assumiam formas esféricas e possuíam massa semelhante caso fossem correspondentes ao mesmo elemento químico.
Modelo de Thomson (pudim de passas) – 1897
Através da descoberta do elétron (partícula constituinte do átomo com carga elétrica negativa), o modelo de Dalton ficou defasado. Assim, com os estudos de Thomson, um novo modelo foi idealizado.
De acordo com este novo modelo, o átomo era uma esfera maciça de carga elétrica positiva incrustada com elétrons. Tornando-se assim eletricamente neutro.
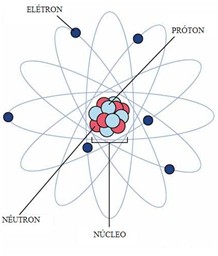
Modelo de Rutherford-Bohr (sistema planetário) – 1908/1910
Rutherford ao bombardear partículas alfa sobre uma lâmina de ouro percebeu que a maioria atravessava a lâmina. Enquanto que uma menor parte sofria pequeno desvio, e uma parte ínfima sofria grande desvio contrário à trajetória.
A partir desse experimento, foi possível perceber que os átomos não eram maciços como se pensava, mas dotados de grande espaço vazio. Assim como, que eram constituídos por um núcleo carregado positivamente e uma nuvem eletrônica carregada negativamente. Essa nuvem eletrônica era composta por elétrons que giravam em órbitas elípticas ao redor do núcleo (assim como os planetas ao redor do sol).
Também constatou-se que a maior parte da massa de um átomo se concentra no núcleo (que rebatia as partículas alfa no sentido contrário do bombardeio).
Mas ainda havia um enigma: De acordo com a teoria das ondas eletromagnéticas, os elétrons ao girarem em torno do núcleo perderiam gradualmente energia, começariam a descrever um movimento helicoidal, e simplesmente cairiam no núcleo. Mas, como isso pode acontecer se os átomos são estruturas estáveis?
Dois anos após Rutherford ter exposto o seu modelo atômico, Niels Bohr o aperfeiçoou. A teoria de Bohr pode ser fundamentada em três postulados:
1) Os elétrons descrevem, ao redor do núcleo, órbitas circulares com energia fixa e determinada. Sendo denominadas órbitas estacionárias;
2) Durante o movimento nas órbitas estacionárias, os elétrons não emitem energia espontaneamente;
3) Quando um elétron recebe energia suficiente do meio externo, realiza um salto quântico: migra entre dois orbitais. E, como tende a voltar ao orbital inicial, a energia recebida é emitida na mesma quantidade para o meio. Sendo essa energia (recebida e emitida) a diferença energética entre os dois orbitais.
Apesar de bastante difundida no ensino médio, o modelo atômico de Rutherford-Bohr é, em parte, ineficiente. Pois:
- Os elétrons, na prática, não realizam trajetórias circulares ou elípticas ao redor do núcleo;
- Não deixa claro o porquê de os elétrons não perderem energia durante seu movimento;
- Não explica a eletrosfera de átomos que possuem muitos elétrons.
Assim, o modelo atômico ideal está sendo obtido a cada dia em que se descobrem mais informações acerca da estrutura íntima da matéria.
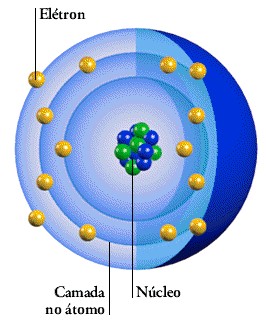
Estrutura de um Átomo
Os átomos são compostos de, pelo menos, um próton e um elétron. Podendo apresentar nêutrons (na verdade, apenas o átomo de hidrogênio não possui nêutron: é apenas um elétron girando em torno de um próton).
- Elétrons – Os elétrons são partículas de massa muito pequena (cerca de 1840 vezes menor que a massa do próton. Ou aproximadamente 9,1.10-28g) dotados de carga elétrica negativa: -1,6.10-19C. Movem-se muito rapidamente ao redor do núcleo atômico, gerando campos eletromagnéticos.
- Prótons – Os prótons são partículas que, junto aos nêutrons, formam o núcleo atômico. Possuem carga positiva de mesmo valor absoluto que a carga dos elétrons; assim, um próton e um elétron tendem a se atrair eletricamente.
- Nêutrons – Os nêutrons, junto aos prótons, formam o núcleo atômico. E, como possuem massa bastante parecida, perfazem 99,9% de toda a massa do átomo. Possuem carga elétrica nula (resultante das sub-partículas que os compõem), e são dispostos estrategicamente no núcleo de modo a estabilizá-lo: uma vez que dois prótons repelem-se mutuamente, a adição de um nêutron (princípio da fissão nuclear) causa instabilidade elétrica e o átomo se rompe.
Os elétrons estão dispostos em 8 camadas que constituem a eletrosfera. Para cada camada, determinado número de subníveis (orbitais) são preenchidos. A mais externa é chamada camada de valência, sendo também a mais energética.
Fontes:
Júlio César Lima Lira: http://www.infoescola.com/quimica/atomo/